
Einführung
Die Infrarot-Strahlung wird auch als Wärmestrahlung bezeichnet, da sie von der Haut als Wärme empfunden wird. Die Strahlung schließt sich den sichtbaren Wellenlängen im Bereich der längeren Wellen an. Die infrarote Strahlung regt als elektromagnetische Strahlung Molekül-Schwingungen und -Rotationen durch Absorption der Strahlung an. Man unterscheidet zwei prinzipielle Möglichkeiten, solche Molekül-Schwingungen oder Rotationen zu messen: - Direkt in Absorption als Infrarot-Spektrum oder - Indirekt in Emission als Raman-Spektrum Die Lage einer Absorptionsbande im IR-Spektrum kann in Einheiten der Wellenlänge des absorbierten Lichts angegeben werden, heute hat sich jedoch die reziproke Wellenlänge, die sogenannte Wellenzahl durchgesetzt. Die Wellenzahl wird in cm-1 gemessen und gibt an, wie viele Wellen der Infrarot-Strahlung auf einen Zentimeter kommen. Wellenzahl (cm-1) = 104 / Wellenlänge (μm) Die Angabe in Wellenzahlen hat den Vorteil, dass sie der Frequenz der absorbierten Strahlung und damit auch der Energie direkt proportional sind. Der normale Bereich eines Infrarot-Spektrums liegt bei Wellenzahlen von 4000 bis 400 -1.
Funktionelle Gruppen im IR-Spektrum
Viele funktionelle Gruppen in organischen Molekülen zeigen charakteristische Schwingungen, die Absorptionsbanden in bestimmten Bereichen des IR-Spektrums entsprechen. Diese Molekülschwingungen sind größtenteils innerhalb der funktionellen Gruppe lokalisiert und erstrecken sich nicht auf den Rest des Moleküls. Dies ermöglicht die Identifizierung solcher funktionellen Gruppen anhand ihrer Absorptionsbande. Diese Tatsache, kombiniert mit einer unkomplizierten Registrierungstechnik, macht die Infrarotspektroskopie zur einfachsten, schnellsten und oft zuverlässigsten Methode, um eine Substanz ihrer Verbindungsklasse zuzuordnen. Meist ist auf einen Blick erkennbar, ob es sich um einen Alkohol, ein Amin oder Keton, eine aliphatische oder aromatische Verbindung handelt. Betrachtet man jedoch die Position und Intensität der Bande genau, lassen sich wesentlich detailliertere Aussagen treffen, z. B. über die Art der aromatischen Substitution, über das Vorhandensein einer Carbonsäure, Ester oder Amid und dergleichen. Darüber hinaus stehen inzwischen zahlreiche Vergleichsspektren in Katalogen oder Datenbanken zur Verfügung. Dadurch lässt sich die unbekannte Substanz oft allein anhand des IR-Spektrums eindeutig identifizieren.
Aufbau eines IR-Spektrometers
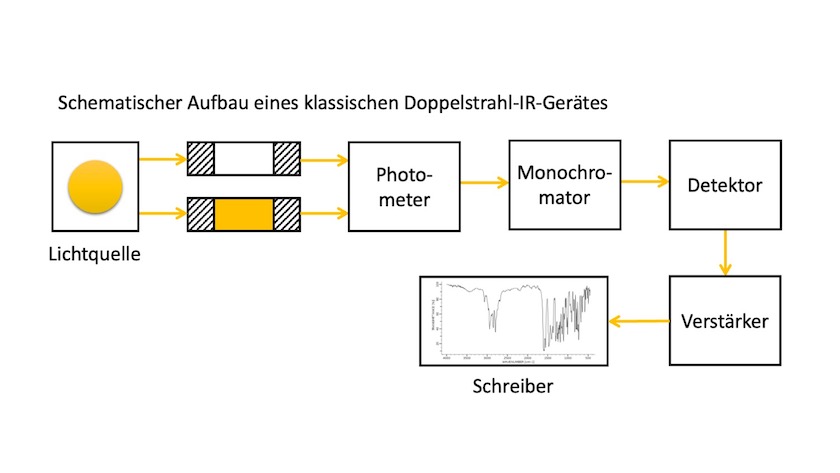 Ein klassisches IR-Spektrometer enthält eine Lichtquelle, die ständig den gesamten Frequenzbereich des Instrumentes emittiert. Häufig verwendete Lichtquellen sind zum Beispiel ein weißglühender Nernst-Stift (Zirkonoxid mit Zusatz von Seltenerdelementen) oder die sog. Globar aus Siliziumkarbid (Brenntemperatur 1500 K). Die kontinuierliche Strahlung wird in zwei Lichtstrahlen gleicher Intensität aufgeteilt, von denen einer die Messprobe durchdringt.
Der zweite Lichtstrahl dient als Referenzstrahl und durchläuft bspw. für Lösungen Küvetten mit reinem Lösungsmittel. Im Photometer erfolgt ein optischer Nullabgleich beider Lichtstrahlen. Ein Monochromator (Prisma oder Beugungsgitter) trennt die entstehende Strahlung. Schließlich nimmt ein Strahlungsempfänger (Detektor) optische Signale auf und wandelt sie in elektrische Signale um. Nach der Verstärkung werden die elektrischen Signale vom Schreiber als Spektrum aufgezeichnet.
Ein klassisches IR-Spektrometer enthält eine Lichtquelle, die ständig den gesamten Frequenzbereich des Instrumentes emittiert. Häufig verwendete Lichtquellen sind zum Beispiel ein weißglühender Nernst-Stift (Zirkonoxid mit Zusatz von Seltenerdelementen) oder die sog. Globar aus Siliziumkarbid (Brenntemperatur 1500 K). Die kontinuierliche Strahlung wird in zwei Lichtstrahlen gleicher Intensität aufgeteilt, von denen einer die Messprobe durchdringt.
Der zweite Lichtstrahl dient als Referenzstrahl und durchläuft bspw. für Lösungen Küvetten mit reinem Lösungsmittel. Im Photometer erfolgt ein optischer Nullabgleich beider Lichtstrahlen. Ein Monochromator (Prisma oder Beugungsgitter) trennt die entstehende Strahlung. Schließlich nimmt ein Strahlungsempfänger (Detektor) optische Signale auf und wandelt sie in elektrische Signale um. Nach der Verstärkung werden die elektrischen Signale vom Schreiber als Spektrum aufgezeichnet.
Moderne IR-Spektrometer
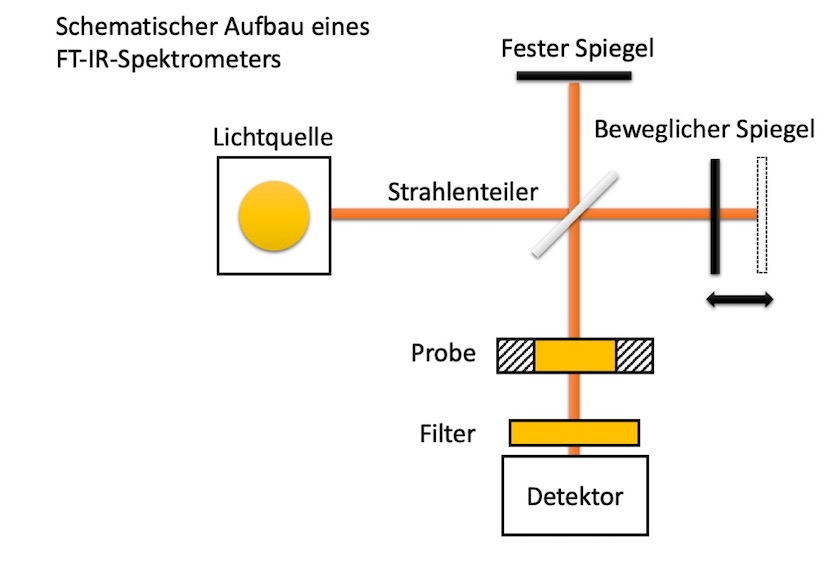 Moderne IR-Spektrometer analysieren alle relevanten Wellenlängen in einer Messung, in diesem Fall spricht man von Fourier-Transformations-IR-Spektroskopie. Das Prinzip beruht darauf, dass die Infrarotstrahlen zunächst durch ein Interferometer geleitet werden, welches aus einem Spiegelsystem besteht. Die Spiegel sind im System so angeordnet, dass sie ein sogenanntes Michelson-Interferometer bilden. Dabei wird der Strahl, der von der Quelle kommt, durch einen Strahlenteiler in zwei Einzelstrahlen aufgespalten. Einer davon wird auf einen festen Spiegel abgestrahlt und reflektiert, der andere auf einen Beweglichen. Danach werden die beiden Strahlen wieder zusammengeführt, so dass sie, abhängig von den im Strahl enthaltenen Frequenzen und vom Spiegelweg, interferieren. So erhält man ein sogenanntes Interferogramm welches in ein IR-Spektrum umgewandelt werden muss. Dieses geschieht durch eine Fourier-transformiert (FT) werden, um die übliche IR-darstellung der Lichtintensität als Funktion der Wellenzahl zu erzeugen. Daher der Name "FT-IR".
Moderne IR-Spektrometer analysieren alle relevanten Wellenlängen in einer Messung, in diesem Fall spricht man von Fourier-Transformations-IR-Spektroskopie. Das Prinzip beruht darauf, dass die Infrarotstrahlen zunächst durch ein Interferometer geleitet werden, welches aus einem Spiegelsystem besteht. Die Spiegel sind im System so angeordnet, dass sie ein sogenanntes Michelson-Interferometer bilden. Dabei wird der Strahl, der von der Quelle kommt, durch einen Strahlenteiler in zwei Einzelstrahlen aufgespalten. Einer davon wird auf einen festen Spiegel abgestrahlt und reflektiert, der andere auf einen Beweglichen. Danach werden die beiden Strahlen wieder zusammengeführt, so dass sie, abhängig von den im Strahl enthaltenen Frequenzen und vom Spiegelweg, interferieren. So erhält man ein sogenanntes Interferogramm welches in ein IR-Spektrum umgewandelt werden muss. Dieses geschieht durch eine Fourier-transformiert (FT) werden, um die übliche IR-darstellung der Lichtintensität als Funktion der Wellenzahl zu erzeugen. Daher der Name "FT-IR".
ATR-FT-IR-Spektroskopie
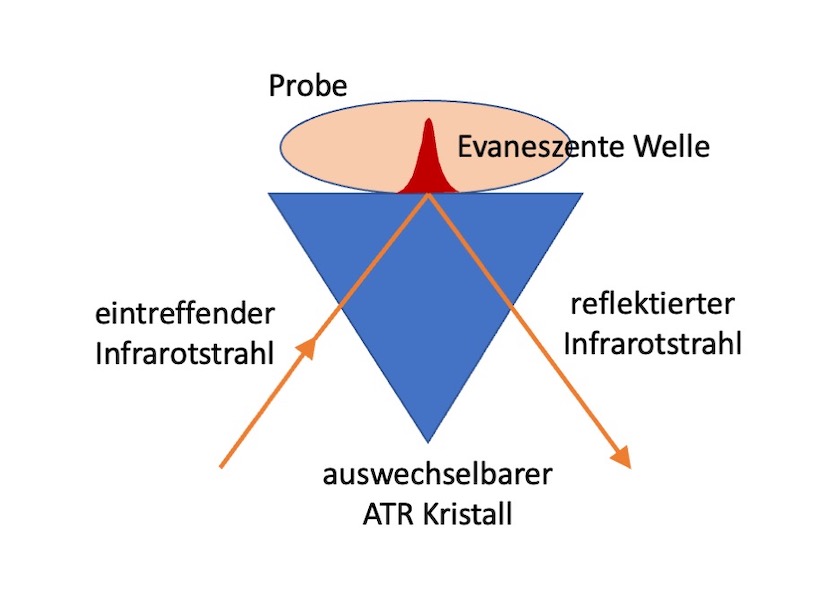 Als aktuelles Verfahren hat sich inzwischen die ATR-FT-IR-Spektroskopie viele aufwendige Probenahmetechniken abgelöst. ATR steht hierbei für abgeschwächte Totalreflexion. Sie ist meist zerstörungsfrei, sehr einfach anzuwenden und geeignet, Feststoffe und Flüssigkeiten einfach und direkt zu analysieren. Das infrarote Licht wird durch ein IR-transparentes Material (z.B. Kristall aus Diamant, ZnSe oder Germanium) geleitet und interagiert mit der Probe, die auf den Kristall gepresst wird. Trifft eine Welle auf ein Medium, in dem sie sich nicht ausbreiten kann, so fällt ihre Amplitude hinter der Grenzfläche nicht direkt auf Null ab, sondern klingt exponentiell ab. Diese abklingende Welle heißt evaneszent und hat etwa die Reichweite einer Wellenlänge. Wird nun eine Probe nahe an die Oberfläche des Lichtwellenleiters gebracht, kann diese mit der evaneszenten Welle wechselwirken. Das im Wellenleiter geführte Licht wird abgeschwächt.
ATR-Spektren sind nicht direkt mit Transmissionsspektren vergleichbar, lassen sich aber mathematisch durch das erweiterte ATR-Korrektur-Verfahren einfach in Transmissionsspektren umrechnen.
Als aktuelles Verfahren hat sich inzwischen die ATR-FT-IR-Spektroskopie viele aufwendige Probenahmetechniken abgelöst. ATR steht hierbei für abgeschwächte Totalreflexion. Sie ist meist zerstörungsfrei, sehr einfach anzuwenden und geeignet, Feststoffe und Flüssigkeiten einfach und direkt zu analysieren. Das infrarote Licht wird durch ein IR-transparentes Material (z.B. Kristall aus Diamant, ZnSe oder Germanium) geleitet und interagiert mit der Probe, die auf den Kristall gepresst wird. Trifft eine Welle auf ein Medium, in dem sie sich nicht ausbreiten kann, so fällt ihre Amplitude hinter der Grenzfläche nicht direkt auf Null ab, sondern klingt exponentiell ab. Diese abklingende Welle heißt evaneszent und hat etwa die Reichweite einer Wellenlänge. Wird nun eine Probe nahe an die Oberfläche des Lichtwellenleiters gebracht, kann diese mit der evaneszenten Welle wechselwirken. Das im Wellenleiter geführte Licht wird abgeschwächt.
ATR-Spektren sind nicht direkt mit Transmissionsspektren vergleichbar, lassen sich aber mathematisch durch das erweiterte ATR-Korrektur-Verfahren einfach in Transmissionsspektren umrechnen.
Grundlagen und Auswahlregeln
Um die Grundlagen bei der Entstehung eines IR-Spektrums verständlich zu machen, kann man sich die Atome als Punktmassen vorstellen, die – wie in der klassischen Mechanik – durch eine elastische Feder verbunden sind. Wird die Feder aus dem Gleichgewichtszustand gedehnt, so entsteht eine rücktreibende Kraft. Beim Loslassen schwingt das System um die Gleichgewichtslage. Die Schwingungsfrequenz eines zweiatomigen Moleküls lässt sich mit dem Modell des harmonischen Oszillators berechnen. Die Schwingungsfrequenz ist um so höher je stärker die Bindung ist und je kleiner die schwingenden Atommassen sind. Im molekularen Bereich treten – im Gegensatz zu einem mechanischen Oszillator – quantenmechanische Effekte auf, was bedeutet, dass die Energie des Schwingungssystems gequantelt ist. Das bedeutet, es gibt nur diskrete Energie- und damit Schwingungszustände. Schließlich ist noch zu berücksichtigen, dass bei Einstrahlung genügend hoher Energie das Molekül dissoziiert und damit zerfällt. Daher iliefert das Modell des anharmonischen Oszillators eine genauere Beschreibung des Schwingungszustands eines zweiatomigen Moleküls. Die diskreten Schwingungszustände werden mit Quantenzahlen beziffert, der Zustand mit der Quantenzahl n=0 nennt man Grundzustand. Die Anregung eines Moleküls kann man sich so vorstellen, dass unter Absorption eines Lichtquants das Molekül von einem Schwingungszustand in den nächsthöheren übergeht. Die Energiedifferenz zwischen den Zuständen entspricht genau der Energie des Lichtquants. Infrarotes Licht wird nur dann absorbiert, wenn das Dipolmoment des Moleküls mit dem elektrischen Vektor des Lichts in Wechselwirkung treten kann. Dieses passiert, wenn die Schwingung asymmetrisch zum Symmetriezentrum erfolgt und das Dipolmoment in den beiden äußeren Schwingungszuständen unterschiedlich ist. Symmetrische Schwingungen sind daher IR-inaktiv (aber Raman-aktiv).
Das IR-Spektrum
Ein komplexes Molekül besitzt viele Schwingungsmöglichkeiten. Je mehr Atome in einem Molekül vorkommen, umso mehr Schwingungsfreiheitsgrade sind erlaubt. Man unterscheidet zwischen Valenzschwingungen und Deformationsschwingungen. Bei Valenzschwingungen ändern sich die Bindungslängen, bei Deformationsschwingungen die Bindungswinkel. Die Schwingungen lassen sich zusätzlich in symmetrische und asymmetrische einteilen. Für die Interpretation von IR-Spektren sind solche Schwingungen nützlich, die sich in erster Näherung auf Einzelbindungen oder funktionelle Gruppen beschränken. Ein IR-Spektrum besteht prinzipiell aus zwei großen Bereichen: oberhalb 1500 cm-1 befinden sich Absorptionsbanden, die funktionellen Gruppen zugeordnet werden können, während der Bereich unterhalb 1500 cm-1 viele Banden enthält und das Molekül als Ganzes charakterisiert. Dieser Bereich wird deshalb als „fingerprint"-Region bezeichnet. Die Verwendung dieses Fingerabdruck-Bereiches zur Feststellung der Identität einer Substanzmit einer authentischen Probe ist in den meisten Fällen sehr zuverlässig.
Quantitative IR-Spektrometrie
Mit Hilfe der IR-Spektrometrie lassen sich auch Konzentrationen von Stoffen in einer Lösung oder Mischung bestimmen. Wie in der UV-Spektroskopie beschriebt das Lambert-Beer-Gesetz den Zusammenhang zwischen absorbiertem Licht und der Stoffkonzentration. Die Absorption ist bei einer bestimmten Wellenlänge proportional der Konzentration und der durchstrahlten Schichtdicke. Die Meßgröße ist das Intensitätsverhältnis vor und nach dem Durchgangs des Lichts durch die Probe bzw. der Logarithmus des Intensitätsverhältnisses, auch Extinktion genannt. Die quantitative Bestimmung einer Probe anhand einer charakteristischen Absorptionsbande mittels IR-Spektroskopie setzt eine empirische Eichkurve voraus, die durch Messung von definierten Lösungen bzw. Mischungen erstellt wird. Die Firma HPMP bietet eine Vielzahl von Infrarotspektroskopischen Untersuchungen an.
← Zurück zu Spektroskopie Weiter zu NMR →